Сертификация химических и фармацевтических продуктов в Израиле – доступ на рынок и ключевые риски
Израильский рынок химических и фармацевтических продуктов относится к числу самых технологичных и строго регулируемых. Здесь высокие стандарты безопасности, жёсткий контроль качества и обязательное соответствие национальным требованиям. Для производителей и импортеров, которые хотят вывести на рынок лекарства, сырьевые вещества, химические реагенты или индустриальную продукцию, необходимо пройти процедуру сертификации и регистрационного одобрения.
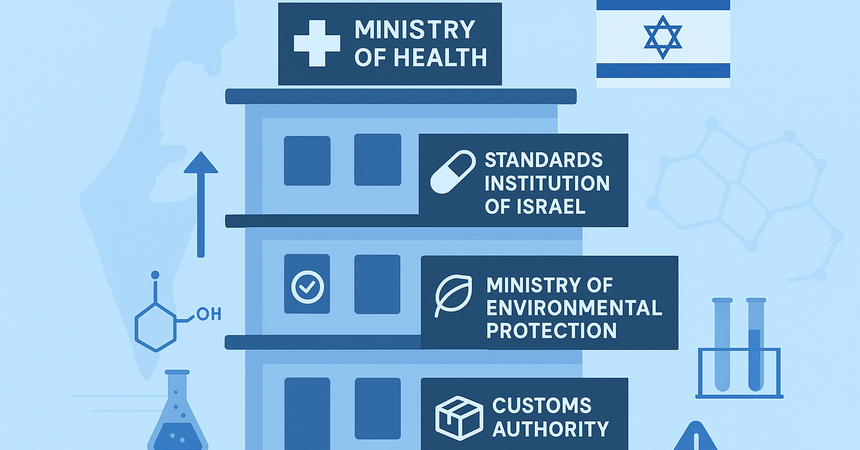
Кто регулирует рынок химических и фармацевтических продуктов в Израиле
Контроль осуществляется сразу несколькими ведомствами:- Министерство здравоохранения Израиля (Ministry of Health – MoH) – отвечает за регистрацию лекарственных средств, медицинских веществ, API и готовых препаратов;
- Standards Institution of Israel (SII) – устанавливает национальные стандарты, проводит проверку документации и лабораторные испытания химической продукции;
- Министерство охраны окружающей среды – регулирует обращение опасных химических веществ, их хранение, импорт и использование;
- таможенные органы – контролируют соответствие маркировки, упаковки и сопроводительных документов.
Какие продукты подлежат обязательной сертификации
В Израиле под обязательное подтверждение соответствия попадают вещества и товары, представляющие риск для здоровья, безопасности или окружающей среды. Среди таких категорий:- лекарственные средства – рецептурные и безрецептурные;
- активные фармацевтические ингредиенты (API);
- химические реагенты и промышленные химикаты;
- косметическая и дерматологическая химия;
- дезинфицирующие растворы и биоциды;
- лабораторные и клинические химикаты;
- вещества, относящиеся к опасным группам – токсичные, коррозийные, огнеопасные.
Как проходит процесс сертификации и разрешения на ввоз
Процедура состоит из нескольких обязательных этапов:- Подача заявки в Министерство здравоохранения или SII – предоставляются технические данные, спецификации, отчёты испытаний, досье, сертификаты GMP и регистрационные материалы.
- Определение применимых стандартов – эксперты уточняют, какие нормы безопасности, качества и маркировки касаются конкретного продукта.
- Лабораторные испытания – проверяются физико-химические свойства, стабильность, чистота, микробиология, токсичность и другие параметры.
- Проверка системы качества производителя – подтверждение соответствия GMP для фармы или ISO 9001/14001 для химической продукции.
- Регистрационное одобрение – после успешной проверки продукт заносится в реестр и получает разрешение на продажу или промышленное использование.
Основные риски для компаний
Импортёры и производители должны учитывать ряд критически важных рисков:- риск отказа из-за неполного регистрационного досье – отсутствие стабильности, токсикологии или данных о производстве может привести к задержкам;
- несоответствие маркировки и инструкции – обязательное наличие текста на иврите, корректных предупреждений, состава и схемы применения;
- задержки на этапе лабораторных испытаний – при несоответствии международным стандартам могут потребоваться повторные тесты;
- экологические требования – для опасных химикатов требуется разрешение на хранение, транспортировку и использование;
- отсутствие локального уполномоченного представителя – без него регистрация зачастую невозможна.
Как ускорить выход продукции на рынок
Чтобы сократить сроки и избежать повторных запросов, рекомендуется:- заранее подготовить полное досье по требованиям Израиля;
- привести документацию, инструкции и маркировку к местным стандартам;
- подтвердить GMP или международные сертификаты качества;
- использовать уже имеющиеся европейские или американские регистрации – Израиль часто учитывает FDA, EMA и другие признанные структуры;
- привлечь локального представителя, который возьмёт на себя взаимодействие с ведомствами.
Преимущества успешной сертификации
Когда продукт получает одобрение израильских регуляторов, компания получает:- доступ к рынку с высокой покупательной способностью;
- доверие со стороны дистрибьюторов, клиник и промышленного сектора;
- упрощённый импорт без дополнительных проверок;
- повышение конкурентоспособности благодаря соответствию международным стандартам;
- возможность участвовать в корпоративных и государственных закупках.